
زوال عقل چیست ؟
انواع زوال عقل و علائم همراه آن
زوال عقل چیست؟
زوال عقل به اختلالات عصبی اشاره دارد که با اختلال پیشرونده حافظه و زوال شناختی مشخص می شود. این بیماری عمدتاً افراد مسن را تحت تأثیر قرار می دهد اما به دلیل عوامل ژنتیکی مختلف می تواند کودکان و افراد جوان تر را نیز تحت تأثیر قرار دهد. شایعترین نوع زوال عقل، بیماری آلزایمر (AD) است که باعث میشود سلولهای مغزی مسئول عملکرد حافظه به آرامی در طول زمان از بین بروند. اشکال دیگر عبارتند از زوال عقل عروقی، دمانس بادی لوی و دمانس فرونتومپورال. علائم اغلب شامل مشکل در به خاطر سپردن رویدادهای اخیر، مهارت های استدلال فضایی ضعیف، تغییرات خلقی، از دست دادن توانایی های زبانی، کاهش تمرکز، افزایش پرخاشگری، یا مشکل در انجام وظایف روزانه است. با پیشرفت زوال عقل، ممکن است منجر به انزوای شدید اجتماعی، پریشانی عاطفی و در نهایت منجر به مرگ شود، مگر اینکه مداخلاتی مانند گروههای حمایتی، درمان دارویی و کمکهای مسکن ارائه شود.
انواع زوال عقل
از دست دادن ذهن، که معمولاً به عنوان علائم شناختی در زوال عقل مانند بیماری آلزایمر یا سایر انواع زوال عقل نامیده می شود، معمولاً شامل طیف وسیعی از مسائل رفتاری و ذهنی است که توسط افراد مبتلا تجربه می شود. این شرایط در چندین دسته کلی ظاهر می شوند، از جمله:
1) مشکلات حافظه: این دسته شامل مشکلات مربوط به یادآوری کوتاه مدت، حفظ طولانی مدت، توجه و حل مسئله است. برخی از نمونههای علائم مرتبط شامل فراموشی، سردرگمی، اختلال در عملکرد اجرایی و مشکل در فرمولبندی افکار منسجم است.
2) کمبود زبان: افراد مبتلا به زوال عقل ممکن است برای برقراری ارتباط موثر با استفاده از کلمات، عبارات، جملات یا پاراگراف ها مشکل داشته باشند. علائم رایج عبارتند از: گفتار نامفهوم، حرکات تکراری و عدم درک زبان گفتاری یا نوشتاری.
3) هذیان، توهم و اختلال فکری: افرادی که این پدیده های روانی را تجربه می کنند ممکن است عبارات نادرست را باور کنند یا تصاویر پوچ را درک کنند در حالی که همزمان درگیر فعالیت های عادی هستند. تفکر هذیانی قابل توجه و باورهای مداوم یا تجربیات توهم آمیز از علائم شناختی جدی زوال عقل در نظر گرفته می شود.
4) تغییرات رفتاری و عاطفی: زوال عقل می تواند منجر به تغییرات قابل توجهی در ویژگی های شخصیتی، احساسات و واکنش به محرک ها شود. برخی از علائم رایج شامل کناره گیری از اعضای خانواده، گوشه گیری، تحریک پذیری، ترس، غم و بیش فعالی است.
5) مشکل در پردازش اطلاعات: اختلال در درک، بی توجهی و کاهش توانایی تمرکز بر جزئیات مربوطه، انجام وظایف روزمره و حفظ روابط را برای افرادی که از زوال عقل رنج می برند چالش برانگیز می کند. علائم مربوط به این حوزه ممکن است شامل مشکلات خواندن، نوشتن، درک دستورالعملها یا تکمیل کارهای پیچیده باشد.
6) تغییر در سبک تفکر: اختلالات شناختی ممکن است منجر به تغییر الگوهای تفکر شود و تفکر منطقی یا خلاقانه را برای بیماران زوال عقل دشوارتر کند. برخی از رفتارهای مشخصه ممکن است شامل عدم مشاهده ارتباط بین چیزهای نامرتبط، مشکل در سازماندهی ایده ها به صورت توالی یا طرح و ناتوانی در پیروی از قوانین یا رویه های ساده باشد.همانطور که قبلاً ذکر شد، همه اشکال زوال عقل با وجود مکانیسمهای زیربنایی متفاوت، برخی از ویژگیهای اصلی را به اشتراک میگذارند. درک جنبه های مختلف از دست دادن ذهن، تشخیص، برنامه ریزی درمانی و کیفیت کلی زندگی را برای افراد مبتلا تسهیل می کندگ
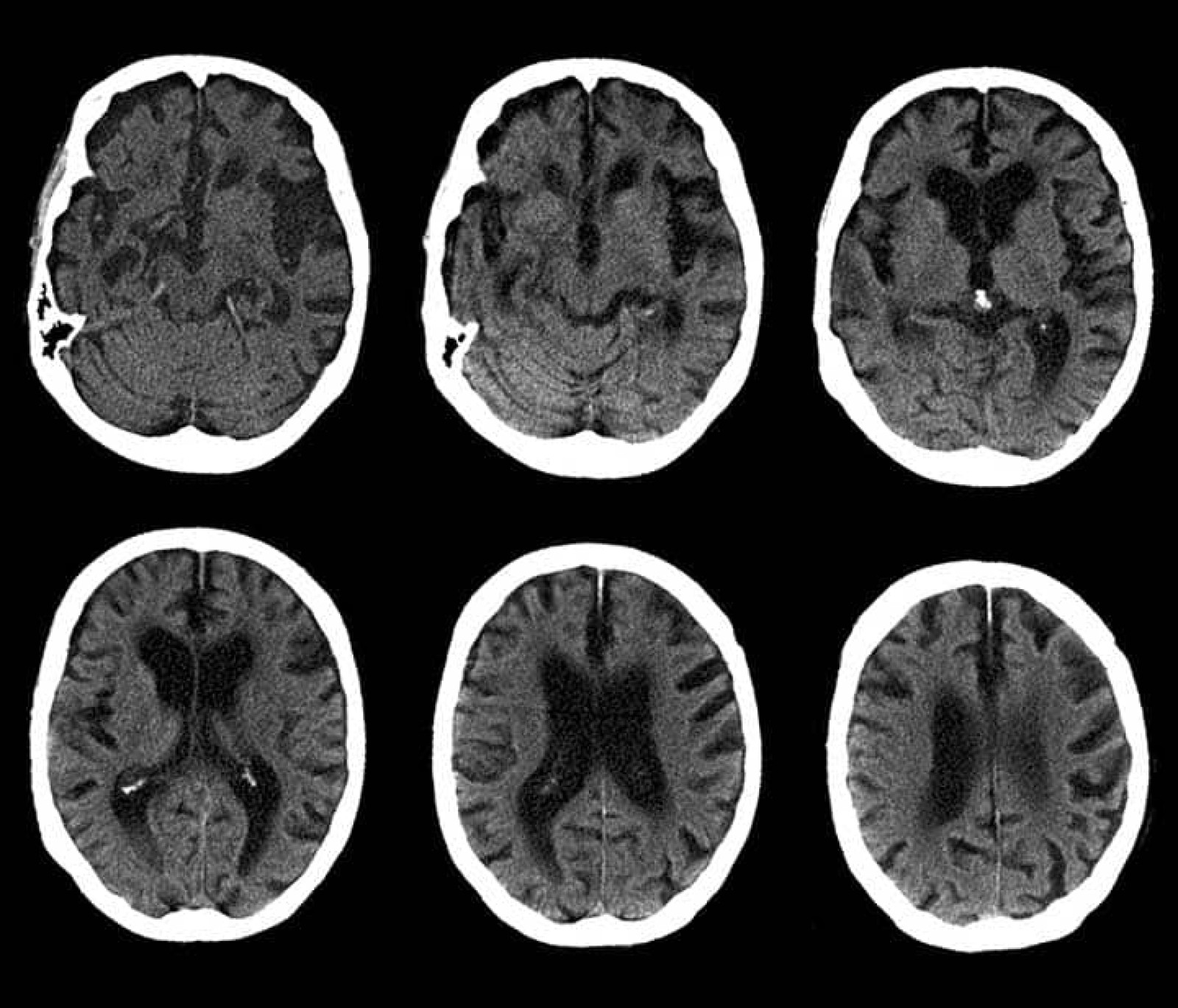 مراحل زوال عقل
مراحل زوال عقل
مراحل زوال عقل
مراحل ناپدید شدن ذهن، که به عنوان پیشرفت عصبی یا توالی سندرم کورساکوف نیز شناخته میشود، تحول تدریجی را توصیف میکند که افراد مبتلا به زوال عقل فروتنومپورال مانند بیماری آلزایمر یا بیماری پارکینسون همراه با دمانس بدن لوی (PD-LB) تجربه میکنند. مقدم بر انواع پیشرفتهتر دمانس مانند زوال عقل مرتبط با اختلال علت عروقی (VaID) و بیماری پیک است. این فرآیند شامل چندین تغییر مشخصه است که در طول زمان به زوال شناختی کمک می کند. مراحل معمولاً در پنج دسته سازماندهی می شوند، اما ممکن است بین تشخیص های این دسته کمی متفاوت باشد:
مرحله اول: مراحل پیش بالینی
تغییرات اولیه عصبی: با شروع در میانسالی، نواحی کوچکی در هیپوکامپ شروع به نشان دادن آسیب غیرطبیعی بافتی می کنند که به طور بالقوه می تواند منجر به مشکلات عصبی شود. تکنیکهای تصویربرداری مغز، مانند تصویربرداری تشدید مغناطیسی ساختاری (MRI) و توموگرافی گسیل پوزیترون (PET)، اتصالات ناهنجار ماده سفید را نشان میدهند که نشاندهنده کاهش جریان خون و افزایش مرگ سلولی در مناطق آسیبدیده است.
نقص های شناختی مقدماتی: افزایش آگاهی و درک در مورد تغییرات عصبی پیش بالینی، پزشکان را وادار می کند تا زودتر به دنبال کمک باشند و این امکان را برای شروع زودتر معیارهای تشخیصی فراهم می کند. تشخیص زودهنگام به محققان و پزشکان اجازه می دهد تا افراد را از نزدیک تحت نظر داشته باشند و استراتژی های مداخله ای را قبل از آشکار شدن تخریب شدید عصبی امکان پذیر می کند.
مرحله دوم: دوره در معرض خطر
بی ثباتی شناختی: با انباشته شدن آسیب مغزی، افراد شروع به نشان دادن بی ثباتی های شناختی می کنند - مانند سردرگمی، فقدان انگیزه، و دشواری در انجام وظایف روزمره. از نظر رفتاری، افراد در این مرحله اغلب برای حفظ روابط با عزیزان خود تلاش می کنند و زمان واکنش تاخیری را در مقایسه با همسالان سالم و مسن نشان می دهند.
تخریب عصب روانشناختی: تست های ارزیابی توانایی های زبان، تشخیص بصری، سرعت پردازش و جهت گیری فضایی کاهش قابل توجهی را نشان می دهند. به نظر می رسد توجه و حافظه فعال در معرض خطر قرار گرفته و تمرکز، به خاطر سپردن جزئیات مرتبط یا انجام کارهای پیچیده را برای افراد آسیب دیده دشوارتر می کند.
مرحله سوم : اختلال شناختی خفیف (MCI)
فاز انتقال : هنگامی که تخریب تجمعی عصبی منجر به تعادل آسیب مغزی و حفظ مدار عصبی می شود، افراد وارد مرحله گذار به سمت زوال عقل می شوند. نشانگرهای رایجی که برای شناسایی افرادی که در معرض خطر بالاتر ابتلا به AD هستند، شامل نمرات پایین معاینه وضعیت ذهنی، مقادیر بالای نسبت تاو/بتا آمیلوئید اندازهگیری شده از طریق اسکن PET، و انواع ژن آپولیپوپروتئین E (ApoE) بالا مرتبط با خطر بیماری آلزایمر است.
بهبود عملکرد و زوال: اگرچه عملکرد شناختی در این دوره تا حدودی بهبود می یابد، افراد همچنان با مشکلات حافظه بلند مدت، مهارت های استدلال و تفکر انتزاعی مواجه هستند. دلیریوم، که قبلاً فقط در مرحله آخر دمانس ذکر شده بود، شروع به آشکار شدن می کند. با این حال، معمولاً تا زمانی که به تشخیص زوال عقل نزدیک شود، با فعالیت های اساسی زندگی روزمره تداخل نمی کند.
مرحله چهارم: دمانس احتمالی یا احتمالی
اختلالات شدید در عملکرد: هنگامی که از آستانه بحرانی برای زوال شناختی عبور کرد، افراد به مرحله نهایی می روند که در آن اختلالات شدید پیشرونده ای را نشان می دهند که بر تفکر، ارتباطات، شخصیت و تحرک تأثیر می گذارد. توهمات بینایی و تغییرات خلقی، از جمله افکار خودکشی یا هیجان شدید، گاهی اوقات با زوال شناخت همراه است.
تشخیص بالینی: اختلال قابل توجه در توانایی حرکتی همراه با شواهد واضحی از بیماری آلزایمر، بیماری پارکینسون همراه با درگیری LB، یا یک بیماری تخریب کننده عصبی دیگر باعث تشخیص رسمی و شروع برنامه های درمانی طراحی شده برای کاهش علائم و کند کردن فرآیندهای تخریب عصبی می شود.
در طول این چهار مرحله، افراد به طور معمول از محیط اطراف خود آگاه می شوند در حالی که محدودیت های شناختی قابل توجهی را تجربه می کنند. شناخت این الگوها پزشکان و مراقبان را قادر میسازد تا حمایت کنند، در مداخلات درمانی با هدف جلوگیری از بدتر شدن علائم شرکت کنند و به افراد در سازگاری با شرایط در حال تغییر کمک کنند. ذکر این نکته ضروری است که اگرچه یک ترتیب منطقی از پیشرفت از نظر تغییرات مغزی قابل مشاهده وجود دارد، همپوشانی بین مراحل متوالی رایج است، و حتی افرادی که علائم زوال عقل را نشان میدهند ممکن است به طور موثر بدون نیاز به تأیید کامل مبانی پاتولوژیک دقیق مدیریت شوند. مفهوم "توالی سندرم کورساکوف" که در سال 1976 توسط دکتر ویلیام هنری کورساکف پیشنهاد شد، امروزه به طور گسترده پذیرفته شده است، اما باید با در نظر گرفتن یافته های تحقیقاتی در حال انجام در رابطه با اعتبار به طور انتقادی نگریست.
علت زوال عقل
دمانس به طیف وسیعی از شرایط اطلاق می شود که با اختلال عملکرد مغزی قابل توجهی که منجر به سطوح مختلف زوال شناختی می شود، مشخص می شود. عوامل متعددی می توانند باعث زوال عقل شوند که هر کدام با مکانیسم های اساسی و فرآیندهای پاتوفیزیولوژیکی مرتبط هستند. در زیر مروری بر علل اصلی و عوامل مؤثر در ایجاد انواع مختلف زوال عقل آورده شده است:
1. بیماری آلزایمر (AD):
- پاتوژنز: بیماری آلزایمر در ابتدا به عنوان نوعی زوال عقل پیری شناخته شد، از هرس نادرست سلول های عصبی به نام نورون ها سرچشمه می گیرد. پلاکهای غیرطبیعی حاوی پروتئینهای بتا آمیلوئید و گرههای پروتئین تاو در سرتاسر مغز تجمع میکنند که منجر به تغییرات فیزیکی برگشتناپذیر و از دست دادن اتصال قشر مغز میشود.
- عوامل خطر: استعداد ژنتیکی نقش مهمی در تعیین اینکه آیا فردی مبتلا به AD می شود یا خیر، بازی می کند. جهشهای خاصی در ژنهای کدکننده پروتئینهای کلیدی درگیر در تجمع تاو و سنتز آمیلوئید، حساسیت به این اختلال تخریبکننده عصبی را افزایش میدهند. عوامل دیگر عبارتند از سن شروع زودرس، سابقه خانوادگی و انتخاب های خاص سبک زندگی مانند سیگار کشیدن و رژیم غذایی نامناسب.
- درمان: هدف درمان های پزشکی در درجه اول به تاخیر انداختن شروع زوال شناختی است. داروهای ضد آمیلوئید تولید آمیلوئیدهای غیرطبیعی را کاهش می دهند، در حالی که عوامل ضد تاو ساختار و فعالیت پروتئین های تاو را تثبیت می کنند تا از آسیب بیشتر جلوگیری کنند. درمان ترکیبی با هدف قرار دادن هر دو هدف، نویدبخش بهبود نتایج شناختی در افراد مبتلا به AD خفیف تا متوسط است. اقدامات حمایتی، مانند ورزش، تعاملات اجتماعی، و تمرین های ذهن آگاهی نیز نقش مهمی در مدیریت علائم و حفظ کیفیت زندگی دارند.
2. دمانس فرونتومپورال (FTD):
- پاتوژنز: مانند بیماری آلزایمر زودرس، زوال عقل فرونتومپورال دارای بسیاری از ویژگی های ژنتیکی و پاتولوژیک با همتای گسترده تر خود است. به طور خاص، تجمع ادخال های درون سلولی که عمدتاً از پپتید آمیلوئید بتا و پروتئین تاو تشکیل شده است منجر به مرگ سلول های عصبی و کاهش شناختی می شود. با این حال، بر خلاف بیماری آلزایمر، به نظر می رسد FTD شامل ساختارهای مغزی خاصی، به ویژه لوب تمپورال قدامی (ATL) و قشر جلوی مغز است.
- عوامل خطر: شناخته شده به داشتن یک الگوی وراثت خانوادگی قوی، FTD اغلب توسط جهش در یکی از سه ژن اصلی ایجاد می شود: APOE4، APP (صرع های ظاهرا بدون درد)، یا PSEN1 (presenilins). محرک های محیطی اضافی، مانند ضربه به سر یا قرار گرفتن در معرض سموم، گاهی اوقات منجر به ایجاد این سندرم ناتوان کننده می شود.
- درمان: مانند بیماری آلزایمر، داروهایی که آمیلوئید و دانه های تاو را هدف قرار می دهند، پتانسیل قابل توجهی برای کاهش شدت علائم دارند. بتا اینترفرون ها در برخی از بیماران اثربخشی نشان داده اند، اگرچه مطالعات بیشتری برای تعیین رژیم دوز مطلوب و مشخصات ایمنی آنها مورد نیاز است. علاوه بر این، تحریک بازسازی سیستم بطنی از طریق فرسایش با فرکانس رادیویی یا رادیوسرجری استریوتاکتیک نتایج اولیه امیدوارکنندهای را در درمان هیپرتروفی بطن مرتبط با FTD نشان داده است. همانند سایر زوال عقلها، رویکردهای تقویت شناختی و مراقبتهای حمایتی بهبود کیفیت کلی زندگی بیمار را هدف قرار میدهند.
3. زوال عقل مرتبط با اختلال اتیولوژی عروقی (VaID):
- پاتوژنز: علیرغم اینکه VaID کمتر از بیماری آلزایمر و FTD مورد مطالعه قرار گرفته است، یک موجودیت نوظهور را نشان می دهد که نشانگرهای زیستی همپوشانی را با این دو شرایط به اشتراک می گذارد. از نظر بالینی، VaID شباهت هایی را در زوال شناختی نشان می دهد، اگرچه ویژگی های غیر معمول ریز عروق، تشخیص دقیق را چالش برانگیز می کند. تحقیقات کنونی نشان میدهد که استرس اکسیداتیو مرتبط با پروتئین 2 فضای خارج سلولی (EMSP2) به مرگ سلولهای عصبی و اختلال شناختی در این زیرگروه نادر کمک میکند.
- عوامل خطر: تا به امروز، فاکتورهای ژنتیکی قطعی که VaID را به هر جهش خاص یا مجموعه ای از ژن های جهش یافته مرتبط می کند، به دلیل محدود بودن داده های موجود، مبهم باقی مانده است. عوامل خطر بالقوه می تواند شامل بیماری های ارثی موثر بر متابولیسم لیپید یا التهاب باشد، مانند مولتیپل اسکلروزیس یا دیابت نوع 2. محرک های محیطی، مانند عفونت های ویروسی، پاسخ های خودایمنی، یا قرار گرفتن در معرض فلزات سنگین نیز ممکن است در افزایش حساسیت به این زوال عقل نقش داشته باشند.
 علت زوال عقل
علت زوال عقل
راه های درمان زوال عقل
در پاسخ به سؤال شما در مورد گزینههای درمانی برای اشکال مختلف زوال عقل، توجه به این نکته ضروری است که هر بیماری به استراتژیهای مدیریت فردی بر اساس علت زمینهای، پیشرفت و تظاهرات بالینی نیاز دارد. در حالی که در حال حاضر عوامل دارویی متعددی وجود دارد که برای کاهش یا توقف زوال شناختی در بیماران مبتلا طراحی شده اند، مداخلات چند وجهی جامع شامل مراقبت های حمایتی، آموزش، روان درمانی، و درمان های بالقوه هدفمند، فرصت های بیشتری را برای افزایش کیفیت زندگی بیمار در طول دوره زوال عقل ارائه می دهد. بخشهای زیر راهنماییهایی را در مورد روشهای درمانی فعلی مورد استفاده در رسیدگی به زوال عقل در انواع مختلف ارائه میدهند:
1. بیماری آلزایمر (AD):
- درمان های دارویی:
- داروهای ضد آمیلوئید: عوامل کاهش دهنده پلاک، مانند دونپزیل (آریسپت)، گالانتامین (رازاداین) و ممانتین (نامندا)، به کاهش مشکلات حافظه مرتبط با تشکیل پلاک آمیلوئید کمک می کنند و در عین حال عوارض جانبی مربوط به افزایش عملکرد دوپامینرژیک و پارکینسونیسم را که در آن مشاهده می شود به حداقل می رساند. مراحل اولیه بعد از میلاد
- عوامل ضد تاو: تائوپاتی ها نشان دهنده یک هدف جذاب برای توسعه درمان های جدید هستند که قادر به خنثی کردن اثرات مضر پروتئین های تاو اشتباه تا شده مسئول تجمع پیچ خوردگی نوروفیبریلاری هستند. آنتیبادیهای مونوکلونال علیه پروتئینهای تاو انسانی، مانند afatinib، rapamycin و selegiline، شواهد اولیهای را نشان میدهند که از بهبود شناخت و نرخ بقا در مقایسه با گروه شاهد پلاسبو حمایت میکنند. علاوه بر این، مهارکنندههای مولکولی کوچک، از جمله بوسنتان، آزاکسولباید، و کلوزاپین N-اکسید، بهعنوان درمانهای بالقوه ضد تاو مورد بررسی قرار گرفتهاند که در کارآزماییهای بالینی امیدوارکننده هستند.
- اقدامات مراقبتی حمایتی:
- ورزش درمانی: درگیر شدن در فعالیت های بدنی منظم می تواند عملکرد شناختی را به طور قابل توجهی افزایش دهد و زمین خوردن را در بین افراد مبتلا به AD کاهش دهد. تحقیقات نشان می دهد که تمرینات قدرتی ممکن است در بهبود سرعت راه رفتن و تعادل مفید باشد و در نهایت برای عملکرد روزانه و رفاه کلی مفید باشد.
- تعامل اجتماعی: حفظ روابط مثبت با دوستان، همسایگان و اعضای جامعه نه تنها به کاهش احساس انزوا کمک می کند، بلکه حمایت عاطفی را فراهم می کند و ناراحتی علامتی را کاهش می دهد. تشویق شرکت در فعالیت های گروهی، کار داوطلبانه، یا پیوستن به باشگاه های محلی می تواند ارتباطات اجتماعی سالم را در میان چالش های رو به وخامت سلامت روان تقویت کند.
- مشاوره پایبندی به دارو: بیماران مبتلا به AD اغلب با به خاطر سپردن و مصرف صحیح داروهای تجویز شده خود مشکل دارند، که می تواند منجر به عوارض جانبی و بدتر شدن علائم شناختی شود. ارائه مشاوره شخصی و کمک در ردیابی مصرف دارو می تواند بیماران را برای مدیریت بهتر وضعیت خود و دستیابی به کنترل بیشتر بر رژیم مراقبتی خود توانمند کند.
- آموزش و آموزش مهارت های شناختی: ارائه مطالب آموزشی با تمرکز بر حل مسئله تطبیقی، کارکردهای اجرایی و کسب مهارت های حرکتی می تواند یادگیری و اصلاح رفتار را در افراد مبتلا به AD تسهیل کند. چنین برنامه هایی ممکن است به افراد در ایجاد مکانیسم های مقابله ای جدید و مهارت های کل نگر لازم برای مراقبت از خود و زندگی مستقل کمک کند.
- راهبردهای محافظت عصبی هدفمند:
- MicroRNA ها (miRNA) و فن آوری های خاموش کردن ژن: محققان در حال بررسی استفاده از miRNA ها، به ویژه let-7c/miR-508، برای به تاخیر انداختن شروع زوال شناختی در مرحله آخر بیماری AD از طریق سرکوب هدفمند فعال شدن میکروگلیا و آسیب آکسون هستند. مدلهای پیش بالینی در بهبود نتیجه عملکردی و افزایش زمان بقا در صورت تجویز قبل از شروع علائم، امیدوار کننده هستند.
- سلول درمانی: ایمونوتراپی های تجربی با استفاده از سلول های بنیادی، مونوسیت ها و پلاکت های مشتق شده از اندام های دهنده نتایج دلگرم کننده ای را در مدل های پیش بالینی AD ارائه داده اند. این درمانها به دنبال ترمیم مدارهای عصبی آسیبدیده، بازیابی یکپارچگی میلین و ترویج نوروژنز با تسهیل رشد و بلوغ آستروگلیا، جمعیتی از سلولهای پیش ساز در سیستم عصبی مرکزی هستند.
جلوگیری از زوال عقل
پیشگیری از زوال عقل برای به حداقل رساندن وقوع آن و حفظ عملکرد بهینه مغز در جمعیت های مختلف ضروری است. با درک علل زمینهای، عوامل خطر و استراتژیهای مؤثر برای اقدامات پیشگیرانه، میتوانیم در جهت کاهش بار این اختلال تخریبکننده عصبی گام برداریم. این راهنما بینش هایی را در مورد محرک های اولیه که در ظهور زوال عقل نقش دارند ارائه می دهد، عوامل خطر کلیدی قابل تعدیل را شناسایی می کند، و رویکردهای ابتکارات بهداشت عمومی و درمان های فردی را با هدف شناسایی زودهنگام و تلاش های پیشگیری مورد بحث قرار می دهد.
درک علل:
زوال عقل با اختلال پیشرونده در حافظه، تفکر، رفتار، ارتباطات، خلق و خو و تحرک مشخص می شود که منجر به از دست دادن استقلال می شود. در حالی که علت دقیق به دلیل تحقیقات در حال انجام ناشناخته باقی مانده است، به نظر می رسد عوامل متعددی افراد مستعد را بیشتر از سایرین مستعد ابتلا به زوال عقل می کند. عوامل کلیدی شامل سن، عوامل ژنتیکی، بیماری های عروقی، ضربه به سر، سکته مغزی و قرار گرفتن در معرض مواد شیمیایی یا سموم خاص (مانند آرسنیک، سرب) است. علاوه بر این، سوء مصرف مزمن الکل، مولتیپل اسکلروزیس، بیماری پارکینسون، بیماری هانتینگتون و شرایط متابولیک ارثی مانند بیماری کروتزفلد-جاکوب (CJD) احتمال ابتلا به زوال عقل را افزایش میدهد.
شناسایی عوامل خطر قابل اصلاح:
1. سن: تقریباً 6 درصد از افراد مسن سالانه به زوال عقل مبتلا می شوند. با این حال، برخی از مطالعات نشان می دهد نرخ بروز بالاتر در افراد بسیار مسن (بیش از 90 سال). با افزایش سن انسان، آسیب پذیری در برابر ابتلا به زوال عقل در درجه اول به دلیل ترکیبی از کاهش حجم مغز، کاهش جریان خون به پارانشیم مغز و کاهش غلظت فاکتور نوروتروفیک مشتق از مغز در گردش (BDNF) افزایش می یابد. تا به امروز، هیچ روش پذیرفته شده ای برای مداخله مستقیم در خود پیری برای جلوگیری از زوال عقل وجود ندارد. با این حال، انتخاب های دقیق شیوه زندگی، به ویژه تمرکز بر تغذیه خوب، فعال ماندن، اجتناب از مواد مضر و مراجعه فوری به پزشک در صورت تجربه شکایات شناختی، می تواند به طور غیرمستقیم بر نتایج سلامت مغز تأثیر بگذارد و خطر ابتلا به زوال عقل را در آینده کاهش دهد.
2. ژنتیک: به نظر می رسد پلی مورفیسم های ژنتیکی مرتبط با پروتئین پلاسما نوریتیک (NPR1) و آپولیپوپروتئین E4 (APOE ε4) خطر ابتلا به زوال عقل را افزایش می دهند. مطالعه ای که توسط انجمن بیماری آلزایمر انجام شد نشان داد که حاملان دو نسخه از جهش APOE ε4 تقریباً سه برابر بیشتر از افراد غیر ناقل احتمال ابتلا به بیماری آلزایمر را داشتند. بررسی بیشتر و اعتبارسنجی این یافتهها بدون شک نقش مهمی در شکلدهی مداخلات هدفمند با هدف محافظت از جمعیتهای آسیبپذیر از شروع زوال عقل ایفا خواهد کرد.
3. بیماری های عروقی: اختلالات قلبی عروقی، مانند فشار خون بالا، بیماری عروق کرونر، بیماری شریانی محیطی و حوادث عروقی مغز، خطر ابتلا به زوال عقل را تشدید می کند. غربالگری منظم، مدیریت و مداخله به موقع برای عوامل خطر قلبی عروقی شناسایی شده می تواند به طور قابل ملاحظه ای بروز زوال عقل ناشی از این شرایط را کاهش دهد.
4. ضربه به سر: قرار گرفتن در معرض آسیب شدید سر، به ویژه خونریزی های داخل جمجمه و آسیب های مغزی تروماتیک منجر به هیدروسفالی، در ایجاد زوال عقل نقش دارد. بستری شدن سریع در بیمارستان، توانبخشی فوری، و شروع پروتکل های مدیریت درد مناسب پس از حوادث شدید می تواند به طور قابل توجهی نتایج طولانی مدت را بهبود بخشد. یکپارچه سازی سیستم های شبکه ایمنی قوی برای ارائه خدمات قابل دسترس و مقرون به صرفه در مراکز مراقبت های ویژه برای اطمینان از تشخیص زودهنگام و درمان موثر برای بیماران مبتلا به سندرم های زوال عقل مرتبط با اختلال استرس پس از سانحه (PTSD) ضروری است.
5. سکته مغزی: زوال عقل پس از سکته مغزی یکی از رایج ترین اشکال زوال عقل اکتسابی در سراسر جهان است. تشخیص به موقع شدت سکته مغزی، اجرای برنامههای درمانی مناسب و حفظ بهترین شیوهها در مراقبتهای پرستاری و توانبخشی، همگی از اجزای حیاتی در مدیریت عوامل خطر و ارتقای بهبودی در بازماندگان سکته مغزی هستند که بعد از این رویداد دچار زوال عقل میشوند.
6. قرار گرفتن در معرض مواد شیمیایی: آلودگی محیطی ناشی از فلزات سنگین، آفت کش ها، حلال های صنعتی و رادیونوکلئیدها به رشد ضعیف عصبی و زوال شناختی در کودکان و بزرگسالان کمک می کند.





